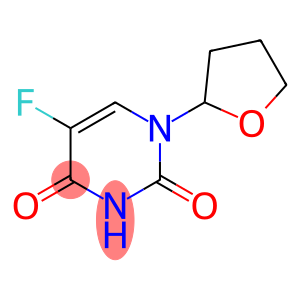
Ftorafur(CAS#17902-23-7)
| Symboles de danger | T – Toxique |
| Codes de risque | 23/24/25 – Toxique par inhalation, par contact avec la peau et par ingestion. |
| Description de la sécurité | S22 – Ne pas respirer les poussières. S36/37/39 – Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage. S45 – En cas d'accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l'étiquette). |
| Numéros d'identification de l'ONU | ONU 2811 6.1/PG 2 |
| WGK Allemagne | 3 |
| RTECS | ANN0450000 |
| Code SH | 29349990 |
| Classe de danger | 6.1 |
| Groupe d'emballage | II |
| Toxicité | DL50 chez la souris (mg/kg) : 900 par voie orale (3 jours) (Yasumoto) ; 750 ip (FR 1574684), également signalé comme 1150 ip (Smart) |
Introduction
La trifluorométhylation est une réaction chimique organique dans laquelle des groupes trifluorométhyle peuvent être introduits dans des molécules organiques à l'aide de réactifs tégafluor tels que le TMSCF3.
Propriétés du tégafluor :
- Le tégafluor est une réaction de conversion de groupe importante, qui peut introduire des groupes trifluorométhyle avec une certaine densité électronique pour modifier les propriétés physiques et chimiques des molécules.
- Les groupes trifluorométhyle ont une forte attraction électronique, ce qui peut augmenter l'électrophilie de la molécule et la solubilité du solvant.
- Les produits de la réaction du tégafluor sont généralement chimiquement stables et biologiquement actifs.
Utilisations du tégafluor :
- Dans le domaine de la science des matériaux, le tégafluor peut modifier les propriétés de surface des matériaux, augmenter leur stabilité et leur résistance aux intempéries.
Méthode de préparation du tégafluor :
- Les réactifs tégafluor couramment utilisés comprennent : TMSCF3, réactif Ruppert-Prakash, etc.
- Les réactions du tégafluor sont généralement réalisées dans une atmosphère inerte, en utilisant un solvant inerte (par exemple chlorure de méthylène, chloroforme) comme milieu réactionnel.
- Les conditions de réaction nécessitent généralement des températures de réaction plus élevées et des temps de réaction plus longs, et nécessitent souvent l'ajout d'un catalyseur (par exemple, un catalyseur au cuivre).
Informations de sécurité sur le tégafur :
- Les réactifs Tegafluor sont toxiques et corrosifs et des précautions appropriées doivent être prises lors de leur manipulation.
- Les gaz (par exemple le fluorure d'hydrogène) produits pendant la réaction sont également dangereux et doivent être utilisés dans des conditions bien ventilées.
- Des précautions doivent être prises pour éviter tout contact avec l'eau ou l'humidité pendant le fonctionnement afin d'éviter des réactions chimiques irréversibles.
- Les réactifs et les produits dans les conditions de réaction du tégafluor nécessitent un traitement et une élimination des déchets appropriés.