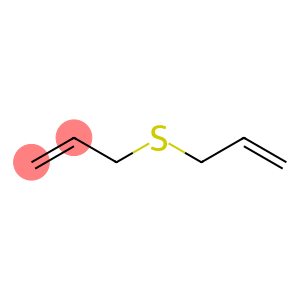
Sulfure d'allyle (CAS#592-88-1)
| Symboles de danger | Xi – Irritant |
| Codes de risque | R10 – Inflammable R36/37/38 – Irritant pour les yeux, les voies respiratoires et la peau. |
| Description de la sécurité | S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l'eau et consulter un médecin. S36 – Porter des vêtements de protection adaptés. S37/39 – Porter des gants appropriés et une protection des yeux/du visage S23 – Ne pas respirer les vapeurs. S16 – Tenir à l'écart des sources d'inflammation. |
| Numéros d'identification de l'ONU | ONU 1993 3/PG 3 |
| WGK Allemagne | 2 |
| RTECS | BC4900000 |
| TSCA | Oui |
| Code SH | 29309070 |
| Classe de danger | 3 |
| Groupe d'emballage | III |
Introduction
Le sulfure d'allyle est un composé organique. Il possède les propriétés suivantes :
Propriétés physiques : Le sulfure d'allyle est un liquide incolore avec une forte odeur âcre.
Propriétés chimiques : Le sulfure d'allyle est capable de réagir avec de nombreux composés, notamment les réactifs électrophiles, tels que les halogènes, les acides, etc. Il peut subir des réactions de polymérisation sous certaines conditions.
Principales utilisations du sulfure d’allyle :
En tant qu'intermédiaire : le sulfure d'allyle peut être utilisé comme intermédiaire dans la synthèse organique et participer à une série de réactions de synthèse organique, par exemple, il peut être utilisé pour synthétiser des halooléfines et des composés hétérocycliques d'oxygène.
Il existe plusieurs méthodes principales pour la préparation du sulfure d'allyle :
Réaction de substitution d'hydrothiol : le sulfure d'allyle peut être formé par des réactions telles que le bromure d'allyle et l'hydrosulfure de sodium.
Réaction de conversion de l'alcool allylique : préparée par la réaction de l'alcool allylique et de l'acide sulfurique.
Du point de vue de la sécurité, le sulfure d'allyle est une substance irritante qui peut provoquer des irritations et des dommages au contact de la peau et des yeux. Évitez tout contact direct avec la peau et les yeux lors de l'utilisation et maintenez de bonnes conditions de ventilation. Le sulfure d'allyle est volatil et doit être évité en cas d'exposition prolongée à des concentrations élevées de vapeurs ou de gaz.